Bilangan Kuantum


1.Pengertian Bilangan Kuantum
Bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.
Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Bilangan kuantum merupakan salah satu ciri khas dari model atom mekanika kuantum atau model atom modern yang dicetuskan oleh Erwin Schrödinger. Dalam mekanika kuantum, bilangan kuantum diperlukan untuk menggambarkan distribusi elektron dalam atom hidrogen dan atom-atom lain. Bilangan-bilangan ini diturunkan dari penyelesaian matematis persamaan schrodinger untuk atom hidrogen menghasilkan fungsi gelombang (ψ) atau orbital atom yang menggambarkan keberadaan elektron dalam atom. Kuadrat dari fungsi gelombang ψ2, memiliki arti khusus yaitu besar probabilitas menemukan elektron dalam ruang dengan volume tertentu di sekitar inti atom. Sebagaimana asas ketidakpastian Heisenberg, posisi elektron dalam atom tidak dapat dipastikan, namun hanya dapat diketahui tempat di mana elektron paling mungkin ditemukan.
| Partkel | Lambang | Massa (gr) | Penemu |
| Proton | 1 1P | 1,673 x 10-24 | Goldstein |
| Neutron | 0 1n | 1,675 x 10-24 | Chadwick |
| Electron | 0 -1e | 9,110 x 10-28 | Thomson |
4.
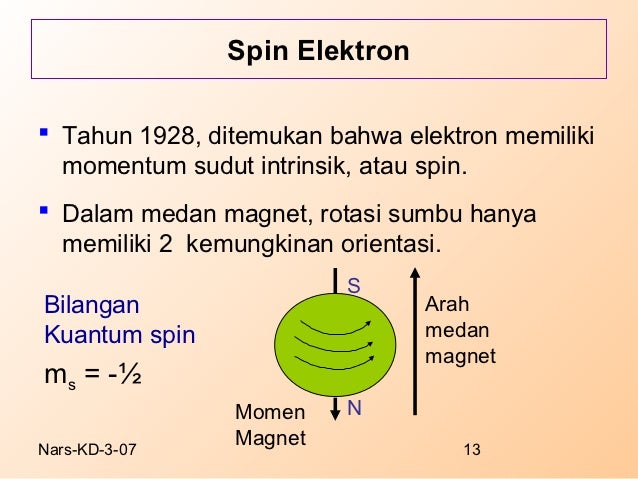
Bilangan kuantum spin (s) ini menyatakan spin elektron pada sebuah atom yang menunjukan arah perputaran (spin) atau rotasi di sebuah elektron pada sumbunya. Arahnya bisa searah jarum jam ataupun berlawanan dengan arah jarum jam. Untuk itu bilangan kuantum spin (s) ini diberi nama ± 1/2 atau -1/2.
4.Diagram Orbital
Setiap orbital mempunyai ukuran, bentuk, dan arah orientasi. Bentuk orbital bergantung pada bilangan kuantum azimuth, sedangkan ukurannya bergantung pada bilangan kuantum utamanya. Orbital-orbital tersebut bergabung membentuk suatu subkulit, dan subkulit bergabung membentuk kulit atau tingkat energi.
A.Orbital s

Orbital s merupakan sub kulit yang harga bilangan kuantumnya = 0. Sehingga subkulit s hanya memiliki 1 orbital saja. Orbital s berbentuk simetris bola sehingga orbital s tidak ada orientasi khusus.
B.Orbital p
B.Orbital p
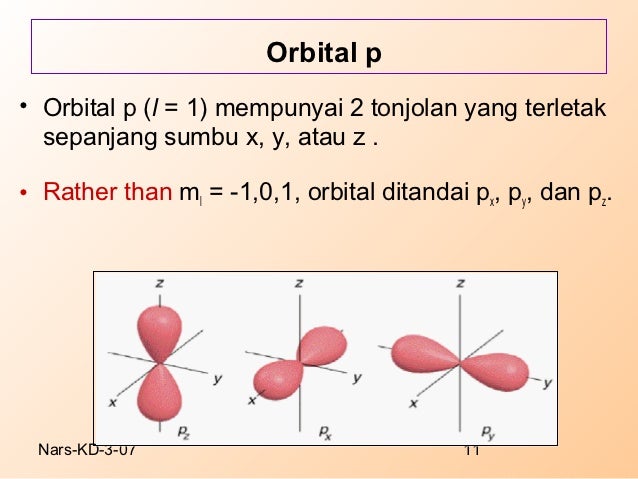
Subkulit p dengan harga bilangan kuantum azimuth (I) = 1 maka harga bilangan kuantum magnetik ada 3 nilai, yaitu -1 ; 0; dan +1.
Subkulit p mempunyai 3 orbital yang ditandai dengan px, py, dan pz. Ketiga orbital di atas disesuaikan dengan orientasinya menurut x, y dan z.
C.Orbital d dan orbital f
- Orbital d
Subkulit memiliki bilangan kuantum azimuth (I) = 2 dengan harga bilangan kuantum magnetik -2 ; -1; 0; +1 dan +2.
1) Orbital dx2-y2 terletak pada bidang xy dan cuping-cupingnya terletak pada sumbu x dan sumbu y.
2) Orbital dz2 terdiri dari satu balon terpilin yang terletak pada sumbu z dan satu daerah berbentuk donat yang terletak pada bidang xy.
3) Orbital dxy terletak pada bidang xy,tetapi cuping-cupingnya terletak diantara sumbu x dan sumbu y.
4) Orbital dxz terletak pada bidang xz dan cuping-cupingnya terletak di antara sumbu x dan sumbu z.
5) Orbital dxy terletak pada bidang xy, tetapi cuping-cuping terletak diantara sumbu x dan sumbu y.
2) Orbital dz2 terdiri dari satu balon terpilin yang terletak pada sumbu z dan satu daerah berbentuk donat yang terletak pada bidang xy.
3) Orbital dxy terletak pada bidang xy,tetapi cuping-cupingnya terletak diantara sumbu x dan sumbu y.
4) Orbital dxz terletak pada bidang xz dan cuping-cupingnya terletak di antara sumbu x dan sumbu z.
5) Orbital dxy terletak pada bidang xy, tetapi cuping-cuping terletak diantara sumbu x dan sumbu y.
- Orbital f
Subkulit dengan nilai I yang Iebih besar, yaitu subkulit f, g, dan seterusnya. Subkulit f, g, dan lain-lain mempunyai jumlah, bentuk serta orientasi orbital yang lebih rumit. Orbital-orbital tersebut jarang digunakan dalam pembentukan ikatan kimia.
5.Konfigurasi Elektron
Setelah memahami hubungan keberadaan elektron dalam atom dengan orbital pada teori atom mekanika kuantum, berikut akan dibahas konfigurasi elektron, yaitu penyusunan elektron-elektron dalam orbital-orbital pada kulit-kulit atom multi elektron. Aturan-aturan dalam penentuan konfigurasi elektron berdasarkan orbital, antara lain:
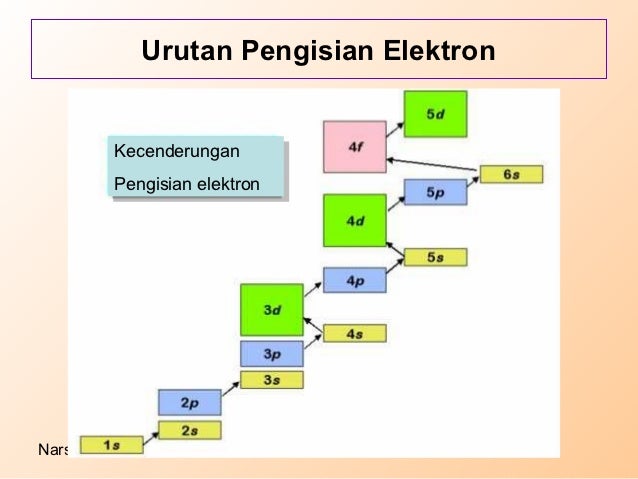
3. Kaidah Hund: Jika ada orbital dengan tingkat energi yang sama, konfigurasi elektron dengan energi terendah adalah dengan jumlah elektron tak berpasangan dengan spin paralel yang paling banyak.
Diagram orbital dan konfigurasi elektron berdasarkan orbital dari 10 unsur pertama
Berdasarkan eksperimen, terdapat anomali konfigurasi elektron dari aturan-aturan di atas. Subkulit d memiliki kecenderungan untuk terisi setengah penuh atau terisi penuh.
Contohnya, konfigurasi elektron 24Cr: [Ar] 4s1 3d5 lebih stabil dibanding [Ar] 4s2 3d4; dan 29Cu: [Ar] 4s1 3d10 lebih stabil dibanding [Ar] 4s2 3d9.
Konfigurasi elektron untuk ion monoatomik (seperti Na+, K+, Ca2+, S2-, Br–) dapat ditentukan dari konfigurasi elektron atom netralnya terlebih dahulu. Pada kation (ion bermuatan positif) monoatomik Ax+ yang bermuatan x+, sebanyak x elektron dilepas (dikurangi) dari kulit elektron terluar atom netral A. Pada anion (ion bermuatan negatif) monoatomik By− yang bermuatan y−, sebanyak y elektron ditangkap (ditambahkan) pada orbital level energi terendah yang masih belum penuh oleh elektron.
Konfigurasi elektron untuk ion monoatomik (seperti Na+, K+, Ca2+, S2-, Br–) dapat ditentukan dari konfigurasi elektron atom netralnya terlebih dahulu. Pada kation (ion bermuatan positif) monoatomik Ax+ yang bermuatan x+, sebanyak x elektron dilepas (dikurangi) dari kulit elektron terluar atom netral A. Pada anion (ion bermuatan negatif) monoatomik By− yang bermuatan y−, sebanyak y elektron ditangkap (ditambahkan) pada orbital level energi terendah yang masih belum penuh oleh elektron.
~







Thanks,sangat bermanfaat:)
BalasHapussangat berguna.. kembangkan lagi kak ❤️
BalasHapusSangat bermanfaat kk terimakasih
BalasHapusMantaap kk...warbiyasaah
BalasHapus🖒
BalasHapusMantap kak
BalasHapusMantap kk
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapussangat bermanfaat
BalasHapusBagus bermanfaat
BalasHapusBisah bermanfaat
BalasHapusNice kak
BalasHapus👍👍👍
BalasHapusGood
BalasHapusSangat mudah di mengerti makasih ya
BalasHapusKerenn,
BalasHapusSangat mudah di mengerti makasih ya
BalasHapusIsi materi baik dan lengkap. Serta mudah dipahami☺
BalasHapusNiceee kak..
BalasHapus👍🏻👍🏻
BalasHapusnice hmm
BalasHapusbagusss
BalasHapusThanks, sangat membantu:)
BalasHapusKerenn
BalasHapusMakasih ya kak sangat bermanfaat, ditunggu postingan selanjutnya!
BalasHapusTerimksh y kak
BalasHapusBagus kak👍 lanjutkan
BalasHapusGood sulis 🐣🐣
BalasHapusMantep
BalasHapussangat bermanfaat :)
BalasHapusTerimakasih, sngat bermanfaat👍
BalasHapusTerimakasih atas info nya...sangat bermanfaat 👍
BalasHapusKerennnyaaa
BalasHapusSangat membantu kak 👍🏻👍🏻
BalasHapusMakasih kakak
BalasHapusNice kak sangat membantu👍
BalasHapusSangat Membantu
BalasHapusSangat Membantu
BalasHapusBagus nii
BalasHapusnice bermanfaat kak makasih ya...
BalasHapusBagus bisa diambil manfaatnya
BalasHapusMantap gan , berguna sekali
BalasHapusMantap
BalasHapusSangat berguna kakak
BalasHapusBisa diambil manfaatnya
Mancay.....
BalasHapusNiceee
BalasHapusBerguna sekali
HapusBagus sekali
BalasHapusPembahasan bermanfaat bosku.
BalasHapusBermanfaat...
BalasHapusSemoga kedepan nya bisa lebih baik
BalasHapusTq kak
BalasHapusKeren
BalasHapusKeren
BalasHapusGood job lis
BalasHapusMantep gan
BalasHapusKereeeennn
BalasHapus